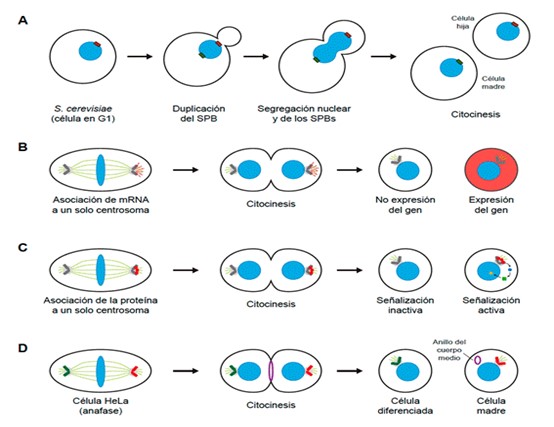
La distribución de los cromosomas durante la división celular por mitosis es posible gracias a su unión al huso, un haz bipolar de microtúbulos que emanan desde los centros organizadores de microtúbulos (MTOCs, “microtubule organizing centers”). Estas estructuras, situadas a ambos polos del huso, reciben el nombre de centrosomas o, en el caso de levaduras, cuerpos polares del huso (SPBs, “spindle pole bodies”)1. Las células inicialmente portan un solo MTOC, que se duplica poco después de comenzar la división para organizar el haz bipolar de microtúbulos del huso. Si bien el genoma, una vez replicado, se reparte de forma equitativa durante mitosis, existen muchos casos de divisiones asimétricas en los que, no obstante, las células resultantes difieren en composición, forma, potencial proliferativo y/o destino celular2. Interesantemente, un gran número de evidencias demuestran que los MTOCs del huso pueden ser utilizados durante estas divisiones para distribuir moléculas y/u orgánulos celulares de forma diferencial. De hecho, un fenómeno fascinante , descubierto originalmente en la levadura Saccharomyces cerevisiae, es la herencia asimétrica durante mitosis de los propios MTOCs del huso. Tras su duplicación, el MTOC pre-existente y el recién generado difieren en composición, morfología y edad. En cada división de S. cerevisiae, el SPB pre-existente es siempre heredado por la célula hija, mientras que la madre retiene el SPB nuevo (Figura 1A)3. Posteriormente, se ha comprobado que se trata de un fenómeno conservado incluso en humanos, que ocurre durante la división de distintas células madre en múltiples organismos. Las células madre de levadura envejecen, perdiendo potencial replicativo a medida que se dividen. Sin embargo, la nueva célula hija formada regenera su potencial replicativo completo tras cada división, gracias a la retención específica en la célula madre de componentes celulares dañados o no funcionales, evitando así que sean transmitidos a la célula hija. En un estudio pionero, nuestro laboratorio ha demostrado recientemente que la distribución diferencial de los SPBs es fundamental para mantener la esperanza de vida en S. cerevisiae y evitar un envejecimiento prematuro de las células4. Si bien la herencia predeterminada de MTOCs del huso sólo tiene lugar durante ciertas divisiones asimétricas, el transporte preferente de componentes celulares asociado a los MTOCs puede producirse independientemente de que estas estructuras se distribuyan diferencialmente. Así, en S. cerevisiae, la localización asimétrica del complejo inhibidor de la salida de mitosis Bfa1-Bub2 al SPB que entra en la célula hija durante anafase depende de los contactos de los microtúbulos que emanan de este SPB con la gemación, pero no de la edad del MTOC5. El transporte asimétrico de moléculas asociado a los MTOCs permite, por ejemplo, la generación de patrones específicos de expresión de proteínas en la célula madre o la hija. Estos patrones pueden lograrse bien por asociación a los MTOCs de las propias proteínas o incluso de los mRNAs que las codifican. Así, estudios en el molusco Ilyanassa obsoleta muestran que determinados mRNAs, incluyendo algunos con funciones fundamentales durante el desarrollo, se asocian con los centrosomas6. Esto facilita la distribución asimétrica de estos transcritos durante la división celular y la generación de complejas pautas de expresión (Figura 1B). Entre las proteínas asimétricamente distribuidas mediante su localización en los MTOCs del huso se encuentran elementos clave de las rutas de señalización que controlan el ciclo celular, siendo su asociación a estas estructuras fundamental para una correcta regulación espacial y temporal de la mitosis (Figura 1C). Igualmente, se ha descrito la interacción de los MTOCs del huso con distintos orgánulos y, también en este caso, dicha asociación puede facilitar la distribución asimétrica de estos componentes celulares. Un ejemplo lo constituye el anillo del cuerpo medio (MR, “midbody ring”), remanente del anillo contráctil de citocinesis y heredado sólo por una de las células hijas. Fascinantemente, se ha comprobado en células HeLa que el MR es heredado frecuentemente por la célula que recibe el centrosoma madre, y que además la herencia del MR parece correlacionarse con la adopción de un destino celular determinado, siendo normalmente retenido por las células madre o células cancerosas, mientras que es perdido por aquellas que son inducidas a diferenciarse (Figura 1D)7. De igual modo, se ha postulado que otros orgánulos como las mitocondrias también podrían distribuirse de forma asimétrica en base a su asociación con los MTOCs del huso4. La relación existente entre los procesos de generación de asimetría durante la mitosis y fenómenos tan relevantes como el envejecimiento o la diferenciación celular hace que el estudio de las divisiones asimétricas sea de enorme importancia2. En este contexto, los procesos de transporte diferencial asociado a la distribución de los MTOCs del huso durante la división celular suponen mecanismos de generación de asimetría relativamente desconocidos todavía, cuya elucidación será fundamental para entender las bases moleculares de ciertos tipos de enfermedades como el cáncer o procesos neurodegenerativos, que podrían estar asociadas a defectos en el mismo.
Referencias:
- Wu, J. & Akhmanova, A. (2017). Annu Rev Cell Dev Biol 33, 51-75.
- Neumuller, R. A. & Knoblich, J. A. (2009). Genes Dev 23, 2675-2699.
- Pereira, G. et al. (2001). EMBO J 20, 6359-6370.
- Manzano-Lopez, J. et al. (2019). Nat Cell Biol 21, 952-965.
- Monje-Casas, F. & Amon, A. (2009). Dev Cell 16, 132-145.
- Lambert, J. D. & Nagy, L. M. (2002). Nature 420, 682-686.
- Kuo, T. C. et al. (2011). Nat Cell Biol 13, 1214-1223.
