El estudio de la agregación de proteínas, una disciplina tradicionalmente minoritaria y originalmente restringida al ámbito biotecnológico, ha experimentado un renacimiento en las últimas dos décadas, a partir del momento en que se evidenció que era la causa subyacente en diferentes patologías humanas, convirtiéndose este campo de investigación en uno de los más excitantes hoy en día. El número de enfermedades humanas que se asocian directa o indirectamente a la agregación de proteínas no deja de crecer, incluyendo enfermedades neurodegenerativas como Alzheimer o Parkinson, pero también otras como Diabetes de tipo II, cardiomiopatías, cataratas o algunos tipos de cáncer.
Las proteínas son los caballos de batalla de la célula, ejecutando la multitud de funciones que ésta requiere para vivir. De manera general, para cumplir su función, las cadenas de proteína, que inicialmente nacen desplegadas en los ribosomas, deben adoptar una estructura tridimensional definida conocida como estructura nativa. Cuando esta conformación no puede ser adquirida o no puede ser mantenida, en muchos casos, las proteínas se auto-ensamblan para formar depósitos insolubles. La formación de estos agregados provoca la pérdida de la función de la proteína que los conforma, satura el sistema de control proteico de la célula (chaperonas y proteasas), secuestra proteínas con funciones esenciales y puede ser tóxica per se. Por lo tanto, no es de extrañar que se asocie a estados patológicos. Lo sorprendente es que este fenómeno no se restringe al número relativamente pequeño de proteínas implicadas en enfermedades, sino que potencialmente cualquier proteína puede agregar, y de hecho se asume que esta capacidad es una propiedad intrínseca de las mismas. Esta sorpresa lo es menos ahora que conocemos que, al contrario de lo que tradicionalmente pensábamos, el estado nativo no es el más estable de los que una proteína puede adquirir, sino que éste corresponde a un estado agregado altamente ordenado conocido como fibra amiloide, que supone un pozo termodinámico en el espacio conformacional en el que multitud de proteínas tienen el riesgo de caer.
Estudios computacionales a gran escala han permitido explicar por qué la agregación está tan extendida en el universo proteico, demostrando que la presencia de secuencias cortas con propensión a agregar es ubicua en todos los proteomas y que de hecho algunas de ellas tienden a estar evolutivamente conservadas.
La pregunta es obvia, ¿si la agregación es potencialmente tóxica, por qué la mantenemos y no la eliminamos progresivamente de la población, como ocurre con las mutaciones deletéreas? ¿Qué beneficios proporciona a los organismos que hace que les merezca la pena asumir ese riesgo?
Justo ahora empezamos a obtener las respuestas a esas preguntas y a vislumbrar que eso es así porque el establecimiento de las interacciones funcionales y las interacciones anómalas que dan lugar a agregados tóxicos son dos caras de la misma moneda, que se basan esencialmente en los mismos principios fisicoquímicos. En las proteínas, la regiones con alta propensión a agregar son ricas en aminoácidos hidrofóbicos y pobres en residuos cargados. Estos son el mismo tipo de residuos que dirigen la formación del núcleo hidrofóbico, en muchos casos el primer acontecimiento que tiene lugar en el plegamiento e indispensable para mantener la estructura globular de las proteínas. Por lo tanto, las regiones con propensión a agregar son indispensables para mantener la estructura y asegurar el plegamiento en un tiempo biológicamente relevante, de tal manera que, en muchas ocasiones, cuando introducimos cambios en esas regiones con la intención de reducir la tendencia a agregar de una proteína sólo conseguimos desestabilizarla o incluso evitar que adopte una estructura definida.
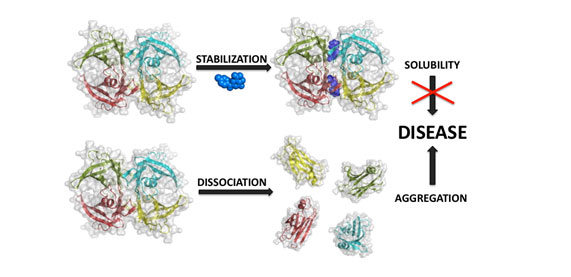
Las regiones con tendencia a agregar parecen jugar asimismo un papel determinante en la formación de la estructura cuaternaria de las proteínas o de complejos proteicos. De esta manera, las interfaces entre subunidades proteicas tienen una mayor propensión a agregar que las superficies correspondientes, que claramente han evolucionado para minimizar el riesgo de agregación, siendo ricas en aminoácidos polares y pobres en residuos hidrofóbicos. Es por ello que la disociación de estructuras cuaternarias en sus subunidades se asocia a un número de enfermedades degenerativas como la polineuropatía familiar o la esclerosis lateral amiotrófica, donde el monómero de la proteína responsable es incapaz de mantener el estado soluble, porque regiones previamente protegidas en la interface ahora se encuentran expuestas a solvente. La estabilización de la estructura cuaternaria mediante moléculas pequeñas, conocidas como chaperonas químicas, se ha mostrado eficaz para evitar la agregación masiva y aliviar la patología en alguna de estas enfermedades (Figura).
La agregación es por tanto mantenida porque es necesaria para el establecimiento de interacciones funcionales y la formación de agregados y el consiguiente desarrollo de enfermedades son el precio que tenemos que pagar como consecuencia de esta necesidad. De todas maneras, la formación de estructuras agregadas no tiene por qué ser intrínsecamente mala, pues ofrecen una estabilidad excepcional y la posibilidad de adoptar formas de organización inaccesibles para las proteínas individuales. De hecho, estas propiedades han sido explotadas por un gran número de organismos, desde bacterias a humanos, para multitud de funciones, como es el favorecer la colonización de nuevos ambientes, la formación de pigmentos, el almacenamiento de hormonas en gránulos a alta densidad o para iniciar la respuesta inmune en respuesta a la presencia de virus. Así, como la mayoría de las cosas en la vida, la agregación tiene su lado bueno y su lado malo, su Yin y su Yang.
Referencias:
- Chiti F., Dobson C.M. (2006) Protein misfolding, functional amyloid, and human disease. Annu. Rev. Biochem. 75:333–366. PMID:16756495.
- Buxbaum J.N., Linke R.P. (2012) A molecular history of the amyloidoses. J. Mol. Biol. 421:142–159. doi: 10.1016/j.jmb.2012.01.024.
- Linding R, Schymkowitz J, Rousseau F, Diella F, Serrano L. (2004). A comparative study of the relationship between protein structure and beta-aggregation in globular and intrinsically disordered proteins. J Mol Biol. 342:345-53. PMID:15313629.
- Castillo V., Ventura S. (2009) Amyloidogenic regions and interaction surfaces overlap in globular proteins related to conformational diseases. PLoS Comput. Biol.5:e1000476. doi: 10.1371/journal.pcbi.1000476.
- Fowler D.M., Koulov A.V., Alory-Jost C., Marks M.S., Balch W.E., Kelly J.W. (2006) Functional amyloid formation within mammalian tissue. PLoS Biol. 4:e6. PMID:16300414.
