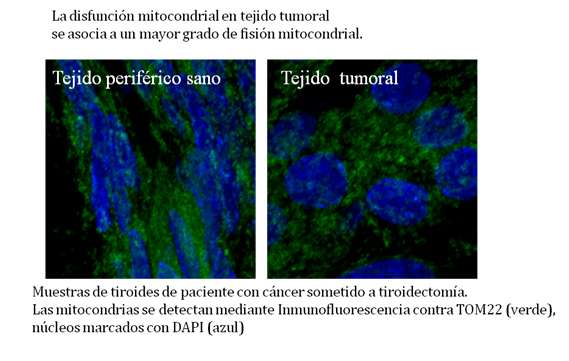
Todas las enfermedades en las que la disfunción metabólica juega un papel relevante se caracterizan porque las células presentan mitocondrias disfuncionales, que tienen una pobre capacidad de síntesis de ATP y producen cantidades elevadas de anión superóxido por unidad de flujo electrónico, generando a su vez otras especies reactivas de oxígeno (1). Esta situación, denominada comúnmente estrés oxidativo de origen mitocondrial, causa entre otros efectos el daño oxidativo en el DNA mitocondrial. La acumulación progresiva de mutaciones en el DNA mitocondrial hace que la célula pierda progresivamente la capacidad de utilizar su mitocondria, su plasticidad metabólica, hasta que se llega a un punto de no retorno, donde la célula no puede responder adecuadamente a un aumento en la demanda energética (2).
La presencia de disfunción mitocondrial en un gran número de patologías está totalmente establecida, pero no así la relación causa-efecto. Parte de nuestro trabajo es estudiar esta relación causal, y una vez demostrada, utilizar el análisis de la función mitocondrial para el diagnóstico y seguimiento de estas enfermedades (3).
Una de las aplicaciones en las que estamos trabajando tiene que ver con el tratamiento con los fármacos antipsicóticos de segunda generación (https://itn-treatment.eu/). Estos fármacos, que son la primera línea del tratamiento de los esquizofrénicos, tienen unos efectos metabólicos muy relevantes, los pacientes aumentan fuertemente de peso y en muchos casos desarrollan diabetes tipo 2 y enfermedades cardiovasculares. Los efectos metabólicos son tan graves que comprometen la adherencia al tratamiento.
Trabajamos sobre la hipótesis de que la capacidad de un organismo dado de catabolizar o degradar estos fármacos, muy dependiente de la actividad mitocondrial, es fundamental para definir su riesgo de desarrollo de alteraciones metabólicas.
Los fármacos son por definición xenobióticos, moléculas que no existen en la naturaleza, por lo que los organismos las reconocen como extrañas. Los fármacos se diseñan para lograr alcanzar todas las células del organismo, en especial los neurofármacos, y para que duren el mayor tiempo posible en circulación, por lo que consisten normalmente en lípidos con estructura anfipática capaz de atravesar membranas biológicas, y muy estables. El metabolismo de los fármacos ocurre fundamentalmente en el hígado y consta de varias fases, la primera suele ser una fase de activación, en la cual se agregan grupos reactivos que facilitan la modificación enzimática, en una segunda fase.
El catabolismo de fármacos tiene por tanto unos requerimientos energéticos muy altos, y requieren de una actividad mitocondrial muy eficiente. Además, los circuitos que regulan el control de la actividad mitocondrial son los mismos que controlan la expresión de las enzimas que se encargan de degradar los fármacos. Cuando el catabolismo de los fármacos no se produce de manera adecuada, se acumulan intermediarios tóxicos que pueden dañar el tejido. Por otra parte, es frecuente que los fármacos sean capaces de entrar en la mitocondria y alterar de manera directa el metabolismo energético por lo que parece fundamental que el organismo deba mantener una buena capacidad de regeneración de la función mitocondrial (biogénesis mitocondrial).
En este contexto, cabe resaltar que los estudios previos de nuestro grupo y de otros han venido a demostrar que la disfunción mitocondrial es suficiente para el desarrollo de enfermedades vasculares (4).
En nuestro grupo estamos evaluando si la determinación de la respuesta temprana a nivel del metabolismo oxidativo a un fármaco en el hígado puede predecir el desarrollo de enfermedades cardiovasculares con el fin de poder ajustar la química al paciente y prevenir así, en la medida de lo posible, el desarrollo de estas enfermedades.
En un paciente no podemos evaluar de manera directa el efecto temprano de una dosis farmacológica en el hígado. Sin embargo, dado que el hígado es el órgano central del metabolismo, el impacto sobre el metabolismo hepático creemos que es medible en sangre, lo que pone a nuestra disposición un medio no invasivo de evaluación.
De hecho, estudios previos del grupo demostraron que es posible medir en sangre cambios en el metabolismo a nivel sistémico y que éstos tienen capacidad predictiva en el contexto cardiovascular (5).
Gracias a que para cada tipo de fármaco hay disponibles una significativa variedad de variantes químicas, se pueden seleccionar aquellos fármacos que supongan un menor estrés metabólico para cada paciente.
El hecho de que la población expuesta a un número considerable de fármacos de manera crónica sea cada vez mayor complica la evaluación de los efectos secundarios a largo plazo de los tratamientos. Creemos que este tipo de aproximaciones puede tener un gran impacto, ayudando a determinar la eficacia y disminuir los riesgos de los tratamientos.
Referencias:
- Biochim Biophys Acta Mol Basis Dis. 2017 May;1863(5):1066-1077. doi: 10.1016/j.bbadis.2016.11.010. Epub 2016 Nov 9.
- Redox Biol. 2016 Aug;8:43-50. doi: 10.1016/j.redox.2015.12.008. Epub 2015 Dec 24.
- Antioxid Redox Signal. 2017 Dec 1;27(16):1332-1346. doi: 10.1089/ars.2016.6836. Epub 2017 Apr 14.
- Angiogenesis. 2016 Apr;19(2):217-28. doi: 10.1007/s10456-016-9502-0. Epub 2016 Mar 7.
- Rev Esp Cardiol (Engl Ed). 2015 May;68(5):408-16. doi: 10.1016/j.rec.2014.05.020. Epub 2014 Nov 5
