Especial Premio Nobel de Química 2012.
La Real Academia Sueca de las Ciencias ha concedido el premio Nobel de Química 2012 a Robert J. Lefkowitz y Brian K. Kobilka por «sus estudios sobre los receptores acoplados a las proteínas G».
Los receptores acoplados a las proteínas G (GPCRs) son proteínas integrales de membrana responsables de la transducción de una amplia variedad de señales del exterior al interior de la célula. La estructura común a todos ellos es la presencia de siete hélices que atraviesan la membrana celular, unidas por lazos intra- y extracelulares. Estos receptores, que representan aproximadamente un 2% del genoma humano, son cruciales para el buen funcionamiento de los organismos por los estímulos y funciones fisiológicas que regulan. Los GPCRs detectan y procesan señales asociadas a la percepción del entorno exterior, como la visión, el gusto y el olfato, además de intervenir en procesos regulados por ligandos endógenos de estructura molecular muy diversa, como aminas biogénicas, aminoácidos, péptidos y lípidos. Un amplio espectro de enfermedades -inmunológicas, cardiovasculares, metabólicas, neurodegenerativas, psiquiátricas y oncológicas- está relacionado con el funcionamiento anómalo de estos receptores, lo que los convierte en la familia de dianas terapéuticas más importante de la industria farmacéutica.
El proceso de transducción de señales se inicia con la unión de una molécula (una hormona, un neurotransmisor; un agonista, en general) o primer mensajero al receptor, en un centro de unión específico del mismo -el centro ortostérico. Las interacciones físico-químicas entre el agonista y el receptor provocan un cambio conformacional en éste que permite la unión y activación de una proteína G. Las proteínas G son trímeros (G αβγ) que reconocen GDP. La activación de la proteína G por el receptor conlleva el cambio de GDP por GTP y la rotura del trímero en dos unidades, Gα-GTP y Gβγ, capaces cada una de ellas de proseguir el proceso de transducción de señales, con la activación de enzimas y canales iónicos y la generación de segundos mensajeros.
Robert Lefkovitz (Duke Univeristy Medical Center) inició su investigación en los GPCRs a principios de los 70. En aquel entonces, la existencia de receptores como entidades discretas formando parte de un sistema de señalización incluyendo enzimas y segundos mensajeros era un tema controvertido. Sus primeros trabajos se dirigieron al desarrollo de técnicas de unión de radioligandos a receptores α- y β-adrenérgicos con el objeto de demostrar de manera directa la existencia de estos receptores y sus respuestas ante situaciones fisiológicas y patológicas. A principios de los 80 consiguió purificar los cuatro subtipos de receptores adrenérgicos (véase revisión en [1]) y, en 1984, reconstruir, a partir de sus tres componentes esenciales -el receptor (β2-adrenérgico), la proteína G (Gs) y el enzima catalítico (adenilil ciclasa)- el sistema de transducción de señales asociado a los GPCRs [2]. En 1986 participa en la resolución por clonación molecular de la estructura prima-ria del receptor β2-adrenérgico [3]. El análisis de su secuencia de aminoácidos identificó la presencia de siete dominios hidrofóbicos transmembrana. Esta característica, que se había observado previamente en rodopsina (el GPCR implicado en el proceso de la visión), se confirmó posteriormente con la clonación de otros receptores, lo que permitió postular que el dominio de siete hélices transmembrana es común a todos los GPCRs. Otro descubrimiento destacable de Lefkowitz es el de que los GPCRs no están limitados a la vía de señalización de las proteínas G sino que existen otras como las asociadas a arrestinas, lo que aumenta la versatilidad y potencial terapéutico de estos receptores.
Brian Kobilka (Stanford University School of Medicine) inició su investigación en los GPCRs a mediados de los 80, participando como miembro del grupo de Lefkowitz en la clonación del receptor β2-adrenérgico [3]. Las contribuciones más destacables de Kobilka han sido en el ámbito estructural, dando lugar a la cristalización de un número significativo de GPCRs. Para ello, fue necesario desarrollar metodologías innovadoras en ingeniería y cristalización de proteínas.
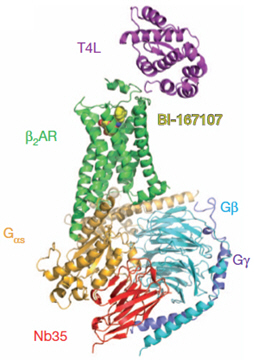
Si distinguimos la rodopsina, el GPCR activado por la luz y cuya estructura cristalina fue determinada por Palczewski en el año 2000 [4], de los GPCRs activados por ligandos difusibles, el número de estructuras de estos últimos ha experimentado un crecimiento acelerado a partir de las primeras estructuras resueltas en 2007 [5,6]. Especialmente destacable ha sido la determinación estructural de un complejo agonista-receptor-proteína G, que ha permitido identificar sin ambigüedad la conformación activa de un GPCR [7].
El previsible incremento de estructuras a corto plazo ayudará a una mejor compresión de los mecanismos moleculares de activación e inhibición de estos receptores, especialmente en el entorno extremadamente complejo en el que ahora nos encontramos: multiplicidad de centros de unión (centros alostéricos cuya ocupación modula positiva o negativamente la actividad del centro ortostérico), multiplicidad de vías de señalización para un mismo receptor (varias proteínas G y otras proteínas como las arrestinas pueden ser activadas por un mismo receptor dependiendo del ligando) y homo- y heteroligomerización entre los receptores. Por su complejidad y presencia en múltiples procesos fisiológicos, los GPCRs constituyen un sistema ideal tanto en investigación básica -biología, farmacología y química computacional- como en investigación aplicada -a través de la búsqueda de fármacos más potentes y seguros.
Referencias:
- Dohlman, H. G. et al. (1991) Model systems for the study of seven-transmembrane-segment receptors. Annu. Rev. Biochem. 60, 653-688.
- Cerione, R. A. et al. (1984) Reconstitution of a hormone-sensitive adenylate cyclase system. The pure beta-adrenergic receptor and guanine nucleotide regulatory protein confer hormone responsiveness on the resolved catalytic unit. J. Biol Chem. 259, 9979-9982.
- Dixon, R. A. et al. (1986) Cloning of the gene and cDNA for mammalian beta-adrenergic receptor and homology with rhodopsin. Nature 321, 75-79.
- Palczewski, K. et al. (2000) Crystal structure of rhodopsin: A G protein-coupled receptor. Science 289, 739-745.
- Cherezov, V. et al. (2007) High-resolution crystal structure of an engineered human beta2-adrenergic G protein-coupled receptor. Science 318, 1258-1265.
- Rasmussen, S. G. et al. (2007) Crystal structure of the human beta2 adrenergic G-protein-coupled receptor. Nature 450, 383-387.
- Rasmussen, S. G. et al. (2011) Crystal structure of the beta(2) adrenergic receptor-Gs protein complex. Nature 477, 549-557.
