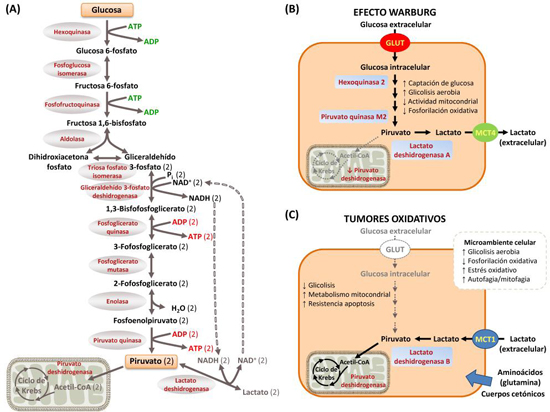
Como es bien conocido, la glicolisis (del griego «glykys», dulce o azúcar, y «lysis», dividir, separar) o vía de Embden-Meyerhof-Parnas hace referencia a la ruta metabólica por la cual, la glucosa (compuesto orgánico de seis carbonos) es degradada en una serie secuencial de 10 reacciones enzimáticas para dar dos moléculas del compuesto de tres carbonos piruvato (Figura 1A). Se considera a esta vía como clave, o incluso la única en determinados tipos celulares para la obtención de energía, conservándose en este proceso parte de la energía libre liberada a partir de glucosa en forma de ATP y NADH. Funciona en ausencia de O2 (anaerobiosis), y está altamente conservada tanto en el número como en los mecanismos implicados en la mayoría de los organismos. Por ello, se considera como la vía más antigua existente para la obtención de energía a partir de moléculas orgánicas, que apareció en el curso de la evolución antes de la acumulación de O2 en cantidades importantes hace unos 2 mil millones de años (1).
La demanda energética, la regeneración del NAD+, los niveles de ciertos metabolitos considerados clave y la presencia de especies reactivas de oxígeno (ROS) permiten ajustar su flujo o promover el proceso inverso, esto es la gluconeogénesis, atendiendo, entre otros, al estado de diferenciación y proliferación celular, y a la disponibilidad de oxígeno y nutrientes (2). El control de la glicolisis es ejercido principalmente a través de sendos mecanismos que afectan a aquellas reacciones de la vía consideradas irreversibles, catalizadas por los enzimas hexoquinasa (HK), fosfofructoquinasa (PFK) y piruvato quinasa (PK) -siendo estos dos últimos específicos de la ruta-, como así también regulándose en algunos casos la entrada del azúcar y la salida de lactato, derivado reducido del piruvato que posibilita la regeneración del NAD+ (a través de los transportadores GLUT y MCT, respectivamente). La heterogeneidad de los enzimas de la vía glicolítica, resultante de la existencia de distintos genes, de variantes en la maduración de sus correspondientes RNA, de diferencias en los niveles de expresión o de modificaciones post-traduccionales, da bases para la flexibilidad metabólica de esta vía (2). En última instancia, los cambios en las propiedades cinéticas de los enzimas, en su respuesta a las interacciones alostéricas o en la estabilidad de los mismos, aseguran la adaptación de la vía a las necesidades funcionales de un tejido específico o, como se ha descrito más recientemente, de una población celular determinada incluso en un mismo tejido, posibilitando la interacción sinérgica entre las células implicadas (3,4).
Típicamente, las células tumorales se caracterizan por un aumento de la captación de glucosa para generar mayoritariamente lactato aún en presencia de oxígeno, fenómeno conocido como efecto Warburg o glicolisis aerobia (Figura 1B). En este efecto se ha implicado a reguladores de la expresión génica como el factor inducible por hipoxia HIF-1, la proteína supresora de tumores p53 o el oncogen c-Myc (5). Así, HIF-1 incrementa la expresión de los transportadores GLUT1 y GLUT3, la síntesis de enzimas glicolíticos como HK1, HK2, fosfoglicerato quinasa 1 o la isofoma M2 de PK, y la producción de lactato y su transporte al espacio extracelular por inducción de la expresión del enzima lactato deshidrogenasa (LDH) A y del transportador MCT4. Mutaciones en p53 conllevan, entre otras alteraciones, una deficiencia en la función mitocondrial; la consecuente reducción en la respiración celular e incremento en ROS, junto a la inactivación de la piruvato deshidrogenasa mitocondrial -enzima responsable de la conversión de piruvato en acetil-Coa- a través de HIF-1, reforzarían la mayor dependencia en la glicolisis de estas células para la obtención de energía. Estas alteraciones conferirían una ventaja selectiva para la supervivencia y proliferación tumoral.
Sin embargo, recientemente se ha observado que no todos los tumores o incluso no todas las células de un mismo cáncer adoptan una remodelación metabólica clásica según el efecto Warburg, sino que se caracterizan por presentar un fenotipo opuesto, de tipo respiratorio con un incremento en la fosforilación oxidativa mitocondrial (3,4,6) (Figura 1C). Es más, en algunos tumores existe lo que se ha denominado sinergismo o acoplamiento metabólico entre las células estromales normales y las tumorales, siendo por tanto el microambiente tumoral clave para la progresión del cáncer. Así, los fibroblastos asociados al tumor son glicolíticos (por estabilización de HIF-1, formación de ROS, autofagia y mitofagia, entre otros mecanismos) y proporcionan lactato, además de aminoácidos como glutamina y cuerpos cetónicos a las células tumorales oxidativas, que son capaces de utilizar estos nutrientes como fuente de energía -gracias a su elevado metabolismo mitocondrial, la sobreexpresión de MCT1 y LDHB, y la inhibición de la glicolisis-, o incorporarlos como precursores metabólicos necesarios para el desarrollo tumoral (4). Esta comunicación metabólica intercelular se ha vinculado directamente con la agresividad del cáncer (4).
Las características de dependencia de la glicolisis mencionadas en el metabolismo tumoral han posibilitado el desarrollo de métodos para el diagnóstico del cáncer humano, como lo es la tomografía por emisión de positrones (PET) tras la administración del análogo de glucosa parcialmente metabolizable [18F]-fluoro-2-desoxiglucosa y detección de su alta captación. Los nuevos hallazgos sobre la remodelación metabólica tumoral y su microambiente han re-orientado el desarrollo de nuevas tecnologías para analizar la heterogeneidad de la vía, lo que a su vez mejorará la evaluación de la respuesta terapéutica, como así también han permitido plantear a los mecanismos mediadores de esta adaptación como dianas para el tratamiento, existiendo actualmente numerosos compuestos en ensayos pre-clínicos y clínicos con potencial de uso médico (2,6).
REFERENCIAS
- Fothergill-Gilmore LA, Michels PAM (1993) Evolution of glycolysis. Prog Biophys Mol Biol. 59, 105-235.
- Warmoes MO, Locasale JW (2014) Heterogeneity of glycolysis in cancers and therapeutic opportunities. Biochem Pharm. 92, 12-21.
- Ghesquière B, Wong BW, Kuchnio A, Carmeliet P (2014) Metabolism of stromal and immune cells in health and disease. Nature 511, 167-176.
- Martinez-Outschoorn U, Sotgia F, Lisanti MP (2014) Tumor microenvironment and metabolic synergy in breast cancers: critical importance of mitochondrial fuels and function. Semin Oncol. 41, 195-216.
- Yeung SJ, Pan J, Lee MH (2008) Roles of p53, MYC and HIF-1 in regulating glycolysis – the seventh hallmark of cancer. Cell Mol Life Sci. 65, 3981-3999.
- Obre E, Rossignol R (2015) Emerging concepts in bioenergetics and cancer research: Metabolic flexibility, coupling, symbiosis, switch, oxidative tumors, metabolic remodeling, signaling and bioenergetic therapy. Int J Biochem Cell Biol. 59, 167-181.



