Los prostanoides (prostaglandinas, prostaciclinas y tromboxanos) son mensajeros lipídicos de vida media corta que derivan del ácido araquidónico (AA) procedente de los glicerofosfolípidos de la membrana. La liberación del AA requiere de la acción de la fosfolipasa A2 o de la fosfolipasa C. El AA puede ser metabolizado por tres vías principales: 1) ciclooxigenasa (COX), 2) lipooxigenasa y 3) citocromo P450 monooxigenasa (1). COX, también conocida como prostaglandina G/H sintasa (PGHS) es la enzima que cataliza el paso limitante en la biosíntesis de prostanoides. Mediante su actividad ciclooxigenasa COX cicla y oxigena al AA y mediante su actividad hidroperoxidasa lo reduce dando lugar a la prostaglandina H2 (PGH2). Finalmente actúan una serie de isomerasas y oxidoreductasas específicas de tejido que emplean como sustrato a PGH2 generando los diferentes productos: prostaglandinas (PGE2, PGD2, PGF2), prostaciclinas (PGI2) y tromboxanos (TXA2). Las acciones biológicas de los prostanoides son múltiples. La PGE2 participa en procesos de regulación del tono vascular, agregación plaquetaria, ovulación, remodelación ósea, así como en procesos febriles, dolor y otros mecanismos fisiológicos de defensa, incluyendo respuesta inflamatoria e inmune. PGF2 produce contracción uterina. PGI2 inhibe la agregación plaquetaria, es vasodilatadora e imprescindible para la implantación del embrión. TXA2 estimula la agregación plaquetaria y la vasoconstricción.
Una vez sintetizadas, las prostaglandinas (PGs) pueden ejercer su acción de forma autocrina o paracrina. Las PGs pueden ser reconocidas por receptores específicos de membrana acoplados a proteínas G y por receptores nucleares del tipo PPAR afectando a la regulación transcripcional de genes metabólicos y de la respuesta inmune. Después de ejercer su acción, las PGs son catabolizadas por la acción de la 15-hidroxiprostaglandina deshidrogenasa.
Existen dos isoformas de COX: una de expresión constitutiva COX-1 y otra de expresión inducible en respuesta a diversos estímulos como factores pro-inflamatorios, hormonas, factores de crecimiento, oncogenes etc. denominada COX-2. COX-1 y COX-2 comparten gran homología estructural y actividad catalítica, sin embargo, su patrón de expresión y sus funciones biológicas son muy diferentes debido a que sus promotores son distintos. Ambas son dianas de un grupo de fármacos tan importantes como los AINES (anti- inflamatorios no esteroideos) y de la aspirina (2). COX-1 está presente prácticamente en todas las células y promueve la producción de PGs cito-protectoras jugando un papel fundamental en la homeostasis de diversos procesos fisiológicos como la agregación plaquetaria, el mantenimiento de la mucosa gástrica y la regulación de la función renal. La expresión de COX-2 es inducida en diversos procesos fisiológicos como la función reproductiva o la protección vascular, así como en determinadas situaciones patológicas como la inflamación y cáncer.
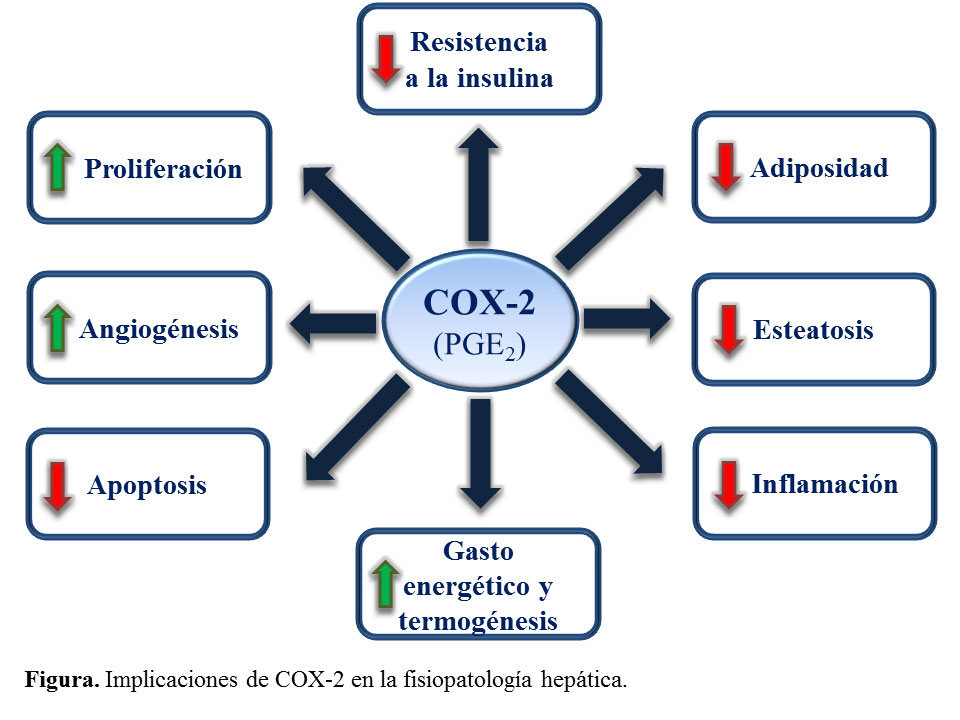
En el hígado, COX-2 no se expresa en el hepatocito adulto y tampoco se induce por estímulos pro-inflamatorios como ocurre en otros tejidos. Sin embargo, COX-2 sí se expresa en células no parenquimales, en el hepatocito fetal y en algunas líneas celulares de hepatoma (3). En nuestro grupo hemos estudiado la relación entre la expresión de COX-2 y la patología hepática tanto en procesos de daño hepático agudo como crónico. COX-2 sólo se expresa en el hepatocito adulto en aquellas situaciones que implican procesos de des-diferenciación y proliferación como en respuesta a una hepatectomía parcial y en algunas enfermedades hepáticas crónicas como la cirrosis y el carcinoma hepatocelular (CHC) (4). Utilizando un modelo transgénico para COX-2 en el hepatocito, hemos demostrado que en procesos de daño hepático agudo que cursan con apoptosis las PGs ejercen una acción protectora debido a su efecto anti-apoptótico/anti-necrótico y además estimulan la proliferación de los hepatocitos (5). El papel de COX-2 en hepatocarcinogénesis es controvertido ya que COX-2 sólo se expresa en los estados iniciales y no en el CHC avanzado (6). En este sentido, COX-2 podría relacionarse con el componente inflamatorio presente en las fases iniciales de la enfermedad hepática crónica y eventualmente con la inducción de carcinogénesis. Estos resultados nos llevaron a proponer que la expresión de COX-2 está relacionada con el componente inflamatorio de la enfermedad del hígado graso no-alcohólico. Nuestros últimos trabajos demuestran que la expresión de COX-2 en hepatocitos protege frente al daño hepático inducido por hiperglicemia, a la resistencia a la insulina y la obesidad. Las PGs aumentan la sensibilidad a la insulina, inducen la termogénesis y la oxidación de ácidos grasos, sugiriendo una mejora de la función mitocondrial y la fosforilación oxidativa (7).
La expresión de COX-2 en enfermedad hepática crónica podría proporcionar una ventaja para el desarrollo del CHC, de modo que la inhibición de la apoptosis en este tipo de procesos otorgaría a COX-2 un papel inductor de daño hepático. Esto contrasta con los procesos de daño agudo en donde COX-2, además de acelerar el proceso de regeneración de la masa hepática, promueve supervivencia evitando la muerte por apoptosis, asignándose en este caso a COX-2 un papel hepatoprotector. Es importante tener en cuenta estos datos a la hora de desarrollar nuevas opciones terapéuticas en las que se incluyan inhibidores de COX-2.
Referencias:
- Smith W.L., Dewitt D.L. & Garavito R.M. (2000) Cyclooxygenases: structural, cellular, and molecular biology. Annu.Rev. Biochem. 69:145-82. PMID:10966456
- Ricciotti E., Fitzgerald G.A. (2011) Prostaglandins and inflammation. Arterioscler. Thromb. Vasc. Biol. 31:986-1000. doi: 10.1161/ATVBAHA.110.207449.
- Callejas N.A., Boscá L., Williams C.S., DuBois R.N. & Martín-Sanz P. (2000) Regulation of cyclooxygenase 2 expression in hepatocytes by CCAAT/enhancer-binding proteins. Gastroenterology 119:493-501. PubMed PMID: 10930384.
- Núñez O., Fernández-Martínez A., Majano P.L., Apolinario A., Gómez-Gonzalo M., Benedicto I., López-Cabrera M., Boscá L., Clemente C., García-Monzón C. & Martín-Sanz P. (2004) Increased intrahepatic cyclooxygenase 2, matrix metalloproteinase 2, and matrix metalloproteinase 9 expression is associated with progressive liver disease in chronic hepatitis C virus infection: role of viral core and NS5A proteins. Gut 53:1665-1672. PMID: 15479690.
- Casado M., Mollá R., Roy R., Fernández-Martínez A., Cucarella C., Mayoral R., Boscá L, and Martín-Sanz P. (2007) Protection against Fas-induced liver apoptosis in transgenic mice expressing cyclooxygenase 2 in hepatocytes. Hepatology 45:631-638. DOI: 10.1002/hep.21556
- Fernández-Álvarez A., Llorente-Izquierdo C., Mayoral R., Agra N., Boscá L., Casado M. & Martín-Sanz P (2012) Evaluation of epigenetic modulation of cyclooxygenase-2 as a prognostic marker for hepatocellular carcinoma. Oncogenesis 1, e23:1-11. doi:10.1038/oncsis.2012.23.
- Francés D., Motiño O., Agra N., González-Rodríguez A., Fernández-Álvarez A., Cucarella C., Mayoral R., Castro-Sánchez L., García-Casarrubios E., Boscá L., Carnovale C., Casado M., Valverde A.M. & Martín-Sanz P (2015) Hepatic cyclooxygenase-2 protects against diet-induced steatosis, obesity and insulin resistance. Diabetes 64: 1522-31. doi: 10.2337/db14-0979.




