Especial Premio Nobel de Fisiología o Medicina 2016.
Autofagia significa «comerse a sí mismo». El término lo acuñó ya en los años 60 Christian de Duve, -premio Nobel en 1974 por el descubrimiento de los lisosomas- y lo definió en contraposición a heterofagia, proceso por el cual la célula degrada componentes ajenos como las bacterias tras fagocitosis o el material extracelular durante la endocitosis.
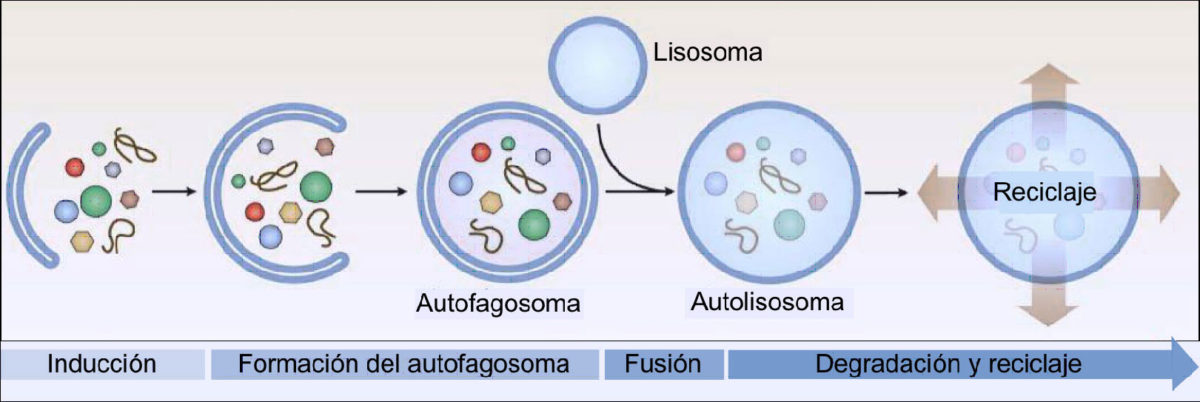
La autofagia comienza cuando el material intracelular que va a ser degradado es englobado por una doble membrana que crece hasta cerrarse por completo para formar un orgánulo llamado autofagosoma. El proceso continúa con la fusión de este autofagosoma con el lisosoma, un orgánulo que contiene las enzimas hidrolíticas que van a degradar el material celular. Posteriormente en el autofagolisosoma, los productos finales de esta degradación, como los aminoácidos, los ácidos grasos, los azúcares y los nucleótidos, salen al citoplasma, a través de transportadores que están en la membrana del lisosoma, donde pueden ser ya reciclados y utilizados en nuevos procesos celulares.
El Premio Nobel de Fisiología o Medicina de este año 2016 ha recaído en Yoshinori Ohsumi del Instituto Tecnológico de Tokio, Japón, por descubrir las bases moleculares del proceso de autofagia. El avance crucial para el campo que ha llevado a cabo el Prof. Ohsumi y por el cual ha sido galardonado con el Premio Nobel, consistió en buscar una estrategia para poder observar los autofagosomas en levaduras -el organismo modelo con el que él trabajaba- e identificar los genes que regulaban el proceso. El laboratorio del Prof. Ohsumi había generado levaduras mutantes de las proteasas de la vacuola, que es el equivalente del lisosoma en los eucariotas superiores. Cuando estas cepas eran sometidas a ayuno, Ohsumi observó que acumulaban los autofagosomas dentro de la vacuola. Además los estudios con microscopía electrónica le permitieron determinar que esos autofagosomas contenían orgánulos celulares así como porciones del citoplasma (1). El Prof. Ohsumi disponía ahora de nuevas herramientas que permitían observar los autofagosomas y estudiar el proceso a nivel bioquímico, manipulando la levadura para obtener nuevos mutantes en los que ya se acumulasen estos autofagosomas. Estos experimentos permitieron encontrar los primeros 15 genes que regulaban el proceso de autofagia a los que denominaron genes apg de: autophagy (2). Todos estos mutantes compartían las mismas alteraciones, no formaban autofagosomas y tenían deficiencias en la degradación de proteínas en situaciones de ayuno, que conducían a la muerte si se prolongaba, además de otras deficiencias importantes en funciones básicas. Estos datos permitieron concluir que en levaduras la autofagia era una importante respuesta para degradar componentes celulares y mantener la viabilidad en situaciones de privación de nutrientes. En la actualidad estos genes han cambiado de nombre y se llaman genes Atg seguido de un número (3). Los quince primeros Atgs son los mismos 15 genes Apgs que descubrió Yoshinori Ohsumi. Trabajos posteriores de su laboratorio permitieron afinar los métodos de estudio del proceso de autofagia así como entender el mecanismo molecular de la formación del autofagosoma (4). Por otro lado, al haber identificado los genes reguladores del proceso fue posible demostrar la existencia de homólogos de estos genes en otras especies como el gusano, las plantas y el hombre (5).
La autofagia es una respuesta esencial frente al ayuno nutricional, y permite la supervivencia celular en situaciones de estrés (6). Hoy en día sabemos de la importancia vital de la autofagia en la fisiología de todos los eucariotas. Gracias a conocer los reguladores moleculares se ha podido manipular el proceso de autofagia y observar las consecuencias para el funcionamiento de las células en los diferentes tejidos. Estos estudios han demostrado, por ejemplo, que es esencial mantener un nivel de autofagia para mantener las neuronas limpias, ya que en animales donde se inhibe la autofagia en las neuronas, éstas acumulan «basura celular», lo que tiene importantes consecuencias para el funcionamiento de las mismas (7, 8). Alteraciones del proceso de autofagia se han observado en numerosas patologías como la diabetes, el cáncer y las enfermedades infecciosas. Entender mejor este proceso es esencial para intentar buscar nuevas terapias para tratar las enfermedades humanas (9).
Referencias:
- Takeshige, K., Baba, M., Tsuboi, S., Noda, T. & Ohsumi, Y. Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction. J Cell Biol 119, 301-311 (1992).
- Tsukada, M. & Ohsumi, Y. Isolation and characterization of autophagy-defective mutants of Saccharomyces cerevisiae. FEBS Lett 333, 169-174 (1993).
- Klionsky, D.J. et al. A unified nomenclature for yeast autophagy-related genes. Dev Cell 5, 539-545 (2003).
- Ichimura, Y. et al. A ubiquitin-like system mediates protein lipidation. Nature 408, 488-492 (2000).
- Mizushima, N. et al. A protein conjugation system essential for autophagy. Nature 395, 395-398 (1998).
- Boya, P. et al. Inhibition of macroautophagy triggers apoptosis. Mol Cell Biol 25, 1025-1040. (2005).
- Hara, T. et al. Suppression of basal autophagy in neural cells causes neurodegenerative disease in mice. Nature 441, 885-889 (2006).
- Komatsu, M. et al. Loss of autophagy in the central nervous system causes neurodegeneration in mice. Nature 441, 880-884 (2006).
- Kroemer, G. Autophagy: a druggable process that is deregulated in aging and human disease. J Clin Invest 125, 1-4 (2015).




